(17分)(2012•广东)苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:

实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
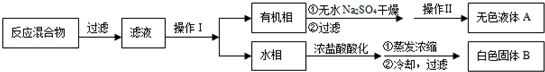
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为 ,操作Ⅱ为 .
(2)无色液体A是 ,定性检验A的试剂是 ,现象是
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, _________ _________ | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中, _________ | 生成白色沉淀 | 滤液含Cl﹣ |
| ③ | 干燥白色晶体, _________ | _________ | 白色晶体是苯甲酸 |
(1)分液,蒸馏(2)酸性KMnO4溶液,紫色溶液褪色(3)
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热,溶解,冷却、过滤 | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含有Cl﹣ |
| ③ | 干燥白色晶体,加热使其融化,测其熔点; | 熔点为122.4℃ | 白色晶体是苯甲酸 |
(4)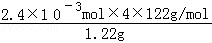 ×100%; 96%
×100%; 96%
(1)依据流程分析混合物分离的实验方法和操作步骤;
(2)依据分离试剂和过程可知,有机相中主要是为反应的甲苯,甲苯是苯的同系物,可以被高锰酸钾溶液氧化;
(3)结合反应化学方程式中生成的产物和流程中分离步骤分析,白色固体B是苯甲酸与KCl的混合物;依据苯甲酸熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;先检验苯甲酸的检验再检验氯化钾的存在;
解:(1)一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按流程分离出苯甲酸和回收未反应的甲苯;所以操作Ⅰ是分离出有机相甲苯,用分液方法得到;操作Ⅱ是蒸馏的方法控制甲苯沸点得到纯净的甲苯液体;故答案为:分液,蒸馏;
(2)依据流程和推断可知,无色液体A为甲苯,检验试剂可以用酸性高锰酸钾溶液,甲苯被氧化为苯甲酸,高锰酸钾溶液紫色褪去;
故答案为:酸性KMnO4溶液,紫色溶液褪色;
(3)通过测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,推测白色固体B是苯甲酸与KCl的混合物,氯化钾可以用硝酸酸化的硝酸银溶液检验氯离子的存在;利用苯甲酸的溶解度特征在25℃和95℃时溶解度分别为0.3g和6.9g;利用不同温度下的溶解度,分离混合物,得到晶体后通过测定熔点判断是否为苯甲酸;
故答案为:
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热,溶解,冷却、过滤 | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含有Cl﹣ |
| ③ | 干燥白色晶体,加热使其融化,测其熔点; | 熔点为122.4℃ | 白色晶体是苯甲酸 |
(4)称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10﹣3mol,苯甲酸是一元弱酸和氢氧化钾1:1反应,所以物质的量相同,注意溶液体积变化计算样品中 苯甲酸的物质的量,计算质量分数;样品中苯甲酸质量分数=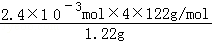 ×100%=96%;
×100%=96%;
故答案为: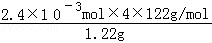 ×100%; 96%
×100%; 96%
点评:本题考查了物质性质的实验分析判断,物质分离条件,试剂选择,操作步骤的理解应用,物质成分的实验设计方案、步骤、试剂,样品纯度的计算,题目难度中等.

