某同学为了测定石灰石样品中碳酸钙的质量分数,取相等质量(12.0g)的五份样品分别和稀盐酸反应,其实验数据记录如下表.(杂质既不溶于水也不跟酸反应)(不考虑二氧化碳在水中的溶解)

| 盐酸的质量(g) | 10 | 20 | 40 | 60 | 80 |
| 二氧化碳的质量(g) | 0.88 | 1.76 | 3.52 | 4.4 | X |
(1)该实验的化学原理______.(用化学方程式表示)
(2)X的数值为______.
(3)稀盐酸的质量分数为______.(精确到一位小数)
(4)石灰石样品中碳酸钙的质量分数是______.(精确到一位小数)
(5)请在图中画出在12.0g样品中加稀盐酸的质量与产生气体质量变化关系的示意图.
(1)依据碳酸钙能与盐酸反应生成氯化钙水和二氧化碳,可得反应原理的方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)由反应的情况可知10g盐酸能生成0.88g二氧化碳,故60g盐酸完全反应则会生成5.28g二氧化碳,而有表格中的数据可知加入60g盐酸时生成的二氧化碳为4.4g,所以表明此时样品中的碳酸钙已经完全反应,消耗盐酸的质量是50g,故加入80g盐酸时生成的二氧化碳质量应该是4.4g;
(3)设12g样品中含碳酸钙的质量为x.消耗氯化氢的质量是y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 4.4g
=100 x
=73 y
,44 4.4g
x=10g y=7.3gg
故稀盐酸的质量分数为
×100%=14.6%7.3g 50g
(4)所以石灰石样品中碳酸钙的质量分数为:
×100%≈83.3%10g 12g
(5)依据分析数据特点可知存在如下反应的数据关系
| 盐酸的质量(g) | 10 | 20 | 40 | 50 | 60 |
| 二氧化碳的质量(g) | 0.88 | 1.76 | 3.52 | 4.4 | 4.4 |
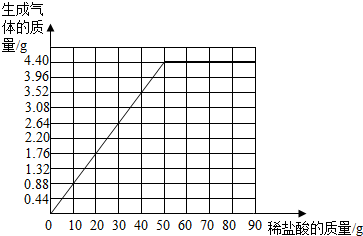
故答案为:(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;(2)4.40;(3)14.6%.(4)83.3%;(5)