高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
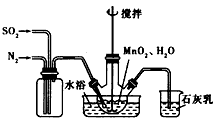
(1)制备MnSO4溶液:在烧瓶中(装置见上图) 加入一定量MnO2和水,搅拌,通人SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2+ H2SO3= MnSO4 +H2O)。
①石灰乳参与反应的化学方程式为__________________________________
② 反应过程中,为使SO2尽可能转化完全,在通人SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有_______________________________
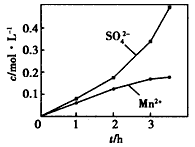
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如上图。导致溶液中Mn2+、SO42-的浓度变化产生明显差异的原因是_________________________
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH= 7.7。请补充由(1) 制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①_______________________________________;
②_______________________________________;
③________________________________________;
④_______________________________________;
⑤低于100℃干燥。
(1)①Ca(OH)2十SO2=CaSO3+H2O; ②控制适当的温度、缓慢通人混合气体;③Mn2+催化O2与H2SO3反应生成H2SO4
(2)①边搅拌边加入NaHCO3(或Na2CO3),并控制溶液pH< 7.7;②过滤,用少量水洗涤2—3次;③检验SO42-是否被洗涤除去; ④用少量C2H5OH洗涤
