瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1)A仪器的名称是______,消石灰的化学式是______.
(2)漂白粉将在U形管中产生,其化学方程式是______.
(3)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是______.
②试判断另一个副反应(写出此反应方程式):______.
(4)京沪高速公路淮安段上行线2010年3月29日晚发生一起交通事故,一辆载有约35吨液氯的槽罐车与一货车相撞,导致槽罐车液氯大面积泄漏.周边村镇27人中毒死亡.如果某市以“液氯泄漏”作为应急预警演习的项目,演习时下列处理措施不合理的是(请填写序号 )______.
①人员就近向地下商场或地铁转移
②及时用毛巾包裹活性炭捂住口鼻
③及时戴上用烧碱溶液湿润过的口罩
④液氯罐中的液氯泄漏时,可将其移入新开挖的坑塘中,并加入熟石灰.
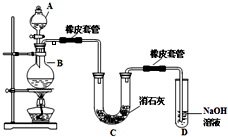
(1)装置中添加浓盐酸通过分液漏斗;消石灰的成分是氢氧化钙;故答案为:分液漏斗 Ca(OH)2;
(2)漂白粉将在U形管中产生,是氯气和氢氧化钙反应生成氯化钙、次氯酸钙、水;其化学方程式为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
故答案为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
(3)①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却; ②置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应,反应的化学方程式为:2HCl+Ca(OH)2=CaCl2+2H2O;
故答案为:用冰水或冷水冷却;2HCl+Ca(OH)2=CaCl2+2H2O;
(4))①根据氯气有毒,密度比空气大;向地下商场或地铁转移,易中毒,故①错误;
②根据活性碳具有吸附作用分析;活性炭具有吸附气体分子作用,可以阻止气体吸入,故②正确;
③根据浓氢氧化钠溶液的强腐蚀性判断;用烧碱溶液湿润过的口罩,具有强腐蚀性,故③错误;
④常温下氯气能溶于水,但氯气在水中的溶解度不大,可以和熟石灰反应,避免造成环境污染;故④正确
故选①③;故答案为:①③.
