问题
填空题
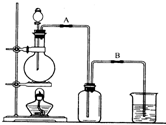
某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如下:
(1)写出该反应的化学方程式______;反应中,氧化剂和还原剂的物质的量之比为______
(2)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是(填序号)______
A.氢氧化钠溶液 B.碳酸钠浓溶液
C.浓硫酸 D.饱和氯化纳溶液.
答案
(1)浓盐酸有还原性,二氧化锰有氧化性,浓盐酸和二氧化锰能发生氧化还原反应生成氯化锰、氯气和水,其反应为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O; △ .
该反应中化合价的变化为:MnO2→MnCl2 ,锰元素由+4价→+2价,1mol二氧化锰得2mol电子;
HCl→Cl↑,氯元素由-1价→0价,1molHCl失去1mol电子,所以其最小公倍数为2,二氧化锰的计量数为1,作还原剂的HCl的计量数为2,物质的量之比等于计量数之比,所以氧化剂和还原剂的物质的量之比为 1:2.
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;1:2; △ .
(2)氯气和水反应生成盐酸和次氯酸,盐酸和次氯酸具有酸性,盐酸是强酸,能和碱或弱酸盐反应,而氯气不与浓硫酸、氯化钠反应,则不能用来吸收残余氯气.
故答案为:CD.
