问题
问答题
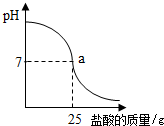
某同学在实验室找到一瓶久置的盐酸,标签上标示的溶质质量分数为32%.为测定其实际的溶质质量分数,该同学利用pH测定仪进行了实验:在烧杯中加入40g溶质质量分数为20%的氢氧化钠溶液,逐滴加入该盐酸,pH测定仪记录了加入盐酸的质量与烧杯中溶液的pH关系(如图所示).
(1)计算该盐酸实际的溶质质量分数.
(2)分析你计算的结果与标签标示的溶质质量分数不一致的可能原因.
答案
(1)当反应后的溶液的PH=7时表示盐酸和氢氧化钠恰好反应,由图看出恰好反应时反应了25g盐酸.
设实际参加反应的HCl的质量为x
HCl+NaOH=NaCl+H2O(1分)
36.5 40
x 40g×20%
=36.5 x 40 8g
解之得:x=7.3g
所以盐酸溶质的质量分数=
×100%=29.2%7.3g 25g
答:该盐酸的实际溶质质量分数为29.2%.
(2)盐酸的质量分数小于32%,主要由于浓盐酸易挥发,逸出HCl气体,使盐酸溶液的溶质质量分数减小
故答案为:盐酸挥发,使HCl减少,溶液的溶质的质量分数减小.
