小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下:
步骤一:配制溶质质量分数为1%的氮氧化钠溶液.
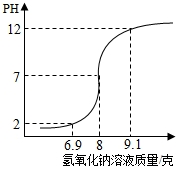
步骤二:向20 克待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使用pH计记录溶液的pH 变化情况,绘制图象如图.
(1)在步骤一中需要用到的玻璃仪器有______(写出两种).
(2)已知发生反应的化学方程式为:NaOH 十HCl=NaCl+H2O,请结合图,计算该稀盐酸的溶质质量分数.(结果精确到0.01% )
(3)在往稀盐酸中逐渐滴入氢氧化钠溶液的过程中,当溶液的pH达到2时,溶液中的溶质有______.(用化学式表示)
(1)溶液配制的步骤:计算、称量和量取、溶解;所以需要的仪器玻璃棒、烧杯、量筒、胶头滴管;故填:器玻璃棒、烧杯;
(2)溶液的pH等于7时恰好完全反应消耗氢氧化钠溶液的质量为8g,
设该稀盐酸的溶质质量分数为x,
NaOH+HCl=NaCl+H2O
40 36.5
8g×1% x×20g
=40 8g×1% 36.5 x×20g
x=0.37%
答:该稀盐酸的溶质质量分数为0.37%;
(3)当溶液的pH达到2时,说明溶液显酸性,盐酸有剩余,所以溶液中的溶质有NaCl、HCl.故填:NaCl、HCl.