问题
问答题
将一铝片投入500mL 3mol/L的H2SO4溶液中.
(1)写出所发生反应的化学方程式并用双线桥分析电子转移的方向和数目.
(2)当生成11.2L(标准状况下)H2时,求此时溶液中H+的物质的量浓度.(假设溶液体积仍为500mL)
答案
(1)反应中Al的化学键由0价升高为+3价,H元素的化合价由+1价降低到0价,氧化剂为H2SO4,还原剂为Al,
用双线桥法可表示如下:
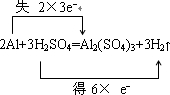
答:

;
(2)n(H2SO4)=0.5L×3mol/L=1.5mol,n(H2)=
=0.5mol,11.2L 22.4L/mol
2Al+3H2SO4=Al2(SO4)3+3H2↑
0.5mol 0.5mol
所以剩余硫酸的物质的量为1.5mol-0.5mol=1mol,
则:反应后溶液中n(H+)=2mol
c(H+)=
=4mol/L,2mol 0.5L
答:溶液中H+的物质的量浓度为4mol/L.
