问题
填空题
油画所用颜料含有某种白色铅化合物,置于空气中,天长日久后会变成黑色PbS,从而使油画的色彩变暗,若用H2O2清洗,则可将PbS转变为白色的PbSO4,从而使油画“复原”,H2O2被还原为H2O
(1)上述“清洗”反应的化学方程式为____________
(2)在此反应中,转移的电子数目是__________
(3)用双线桥表示电子转移的情况_______________
答案
(1)由PbS转变为白色的PbSO4,H2O2被还原为H2O,PbS作还原剂,H2O2作氧化剂,则发生的氧化还原反应为PbS+4H2O2═PbSO4+4H2O,故答案为:PbS+4H2O2═PbSO4+4H2O;
(2)由反应可知,S元素的化合价由-2价升高到+6价,则化合价变化为6-(-2)=8,即转移的电子数目为8e-,故答案为:8e-;
(3)S元素的化合价由-2价升高到+6价,氧元素的化合价由-1降低为-2,则双线桥表示电子转移的情况为
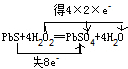 ,故答案为:
,故答案为: