碳族元素包括C、Si、Ge、Sn、Pb。
(1)碳纳米管由单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过______杂化与周围碳原子成键,多层碳纳米管的层与层之间靠______结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为______。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br键的键角______120°(填“>”、“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为______,每个Ba2+与______个O2-配位。
参考答案:(1)sp2 分子间作用力(或:范德华力)
(2)C>H>Si
(3)<
(4)BaPbO3 12
解析:
本题以第ⅣA族元素为载体,涉及选修3《物质结构与性质》知识的综合应用。
(1)石墨晶体是混合型晶体,同一层内碳原子之间以共价键结合成正六边形结构,层与层之间通过范德华力结合,故碳纳米管中碳原子的杂化方式为sp2杂化,层与层之间靠范德华力结合。
(2)电负性越大,非金属性越强,即吸引电子对的能力越强,故电负性的大小关系为C>H>Si。
(3)在SnBr2分子中,中心原子Sn有2对成键电子,1对孤对电子,采用sp2杂化,故键角小于120°。
(4)1个晶胞中有1个Ba2+,Pb4+的个数为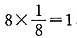 ,O2-的个数为
,O2-的个数为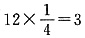 .故化学式为BaPbO3。每个Ba2+与12个O2-配位。
.故化学式为BaPbO3。每个Ba2+与12个O2-配位。
