问题
问答题
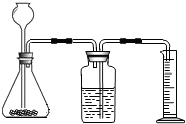
利用右图装置能制取氢气并测定所收集气体的体积.毛毛同学在锥形瓶中装入13g锌粒,往长颈漏斗中加入lOOg稀硫酸,两者恰好完全反应.
(反应的化学方程式为Zn+H2S04═ZnSO4+H2↑)
(1)求稀硫酸中溶质的质量分数.
(2)右图装置采用的是______法收集氢气;若要收集300mL氢气,应选用______
mL(填“10”或“100”或“500”)量筒.
答案
(1)设稀硫酸中含溶质的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
13g x
=65 98
x=19.6g13g x
稀硫酸中溶质质量分数=
×100%=19.6%19.6g 100g
答:稀硫酸中溶质质量分数为19.6%.
(2)产生的氢气排出装置内的水,排出水的体积等于所收集到氢气的体积,因此收集300mL氢气需排出300mL水,则需要选用500mL的量筒进行测定;
故答案为:排水;500.
