如下图所示的物质的相互转变中,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应。常温下,D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%。
 |
请回答下列问题:
(1)写出F的化学式: ;(2)写出G的电子式: ;
(3)反应①的化学方程式为 ;
人们将反应①所涉及的化学工业称为 ;
(4)反应⑤的离子方程式为 ;
高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为
①Na2FeO4具有强氧化性可杀菌消毒
② 。
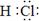 (1)NaClO(2分)(2) (2分)
(1)NaClO(2分)(2) (2分)
(3)2NaCl + 2H2O = H2↑ + Cl2↑+ 2NaOH (2分) 氯碱工业(1分)
(4)2Fe3+ + 3ClO― + 10OH― = 2FeO42― + 3Cl― + 5H2O(2分)
②本身被还原成Fe3+而发生水解生成Fe(OH)3胶体吸附水中杂质以达到净化水的目的。(1分)
A+B电解生成CDE三种物质,常见于NaCl、AgNO3、CuSO4等与水的电解,D、E均是气体基本可以确定是电解NaCl溶液,则C是NaOH,F是NaClO,G是HCl ;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%,H是Fe2O3,I是FeCl3,反应⑤的离子方程式为2Fe3+ + 3ClO― + 10OH― = 2FeO42― + 3Cl― + 5H2O
