已知Cl-和Ag+反应生成AgCl,每次新生成的AgCl中又有10%见光分解成单质银和氯气,氯气又可在水溶液中岐化成HClO3(为强酸)和HCl。而这样生成的Cl-又与剩余的Ag+作用生成沉淀,如此循环往复,直至最终。现有含1.1molNaCl的溶液,向其中加入足量AgNO3,求最终能生成多少克难溶物(AgCl和Ag)?若最后溶液体积为1L,求溶液中H+物质的量浓度是多少?
167.94g 0.12mol/L
本题涉及三个化反应:Ag++Cl-=AgCl↓,2AgCl 2Ag+Cl2;3Cl2+3H2O=6H++ClO3-+5Cl-,
2Ag+Cl2;3Cl2+3H2O=6H++ClO3-+5Cl-,
若有①60Ag++60Cl-=60AgCl,则应有②6AgCl 6Ag+3Cl2,③3Cl2+3H2O=ClO3-+5Cl-+6H+,消去循环量,可运用总反应式求解,①+②+③得:60Ag++55Cl-+3H2O=54AgCl↓+6Ag↓+ClO3-+6H+。
6Ag+3Cl2,③3Cl2+3H2O=ClO3-+5Cl-+6H+,消去循环量,可运用总反应式求解,①+②+③得:60Ag++55Cl-+3H2O=54AgCl↓+6Ag↓+ClO3-+6H+。
据此易得: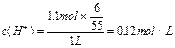 ;
;
难溶物AgCl和Ag的质量为:

