Ⅰ.纯碱的产量是衡量一个国家化学工业发展水平的重要指标。下面是实验室摸拟侯氏制碱法生产原理的主要过程:
①20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体充分加热,得到Na2CO3; ④向③的滤液中加入食盐细粒,析出NH4Cl晶体,过滤,得到NH4Cl。
(1)请写出步骤②和③的化学方程式。 ②:__________; ③:____________。
(2)侯氏制碱法的优点之一是所得的副产品氯化铵是一种氮肥。该化合物遇碱会生成有刺激性气味的气体 _____________(写化学式,下同),此气体可使紫色石蕊试液变蓝,以上反应现象可用于检验氯化铵中的阳离子。若要通过实验区分氯化铵和另一种氮肥硝酸铵,常用的试剂是____________溶液,请比较这两种氮肥中氮元素的质量分数:氯化铵___________硝酸铵(选填“>”、“<”或“=”)。
Ⅱ.侯氏制碱法所得的纯碱中常含有少量氯化钠,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等固定用装置已略去)。
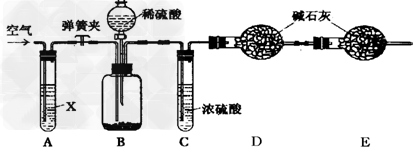
实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g。
试回答:
(1)鼓入空气的目的是_______________,装置A中试剂X最适宜选用_____________。
(2)若没有C装置,则会导致测定结果______________ (填“偏大”或“偏小”)。
(3)E装置的作用是 _________________。
(4)请根据实验中测得的有关数据,计算纯碱样品中碳酸钠的质量分数。(要求:写出计算过程,结果保留一位小数)
Ⅰ.(1)NH4HCO3+NaCl==NH4Cl+NaHCO3↓ ; 2NaHCO3==Na2CO3+H2O+CO2↑
(2)NH3 ;AgNO3 ; <
Ⅱ.(1)驱赶装置中的气体,使反应生成的二氧化碳气体被D中碱石灰完全吸收 氢氧化钠溶液
(2)偏大
(3)防止空气中的二氧化碳与水蒸气被D中碱石灰吸收使测定结果偏大
(4)解:反应生成二氧化碳的质量为:85.6g-83.4g=2.2g
设纯碱样品中Na2CO3的质量为x。
Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
106 44
x 2.2g
106︰44=x︰2.2g ,x=5.3g
∴纯碱样品中碳酸钠的质量分数为: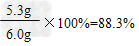
答:纯碱样品中碳酸钠的质量分数为88.3% 。
