问题
计算题
将2.80 g CaO与500 mL某浓度的盐酸充分反应,将所得溶液平均分成两份。向其中一份中加入足量的AgNO3溶液,生成的沉淀干燥后的质量为14.4 g;向另一份溶液中加入足量Zn粒,产生0.560 L(标准状况)气体。计算所用盐酸中HCl的物质的量浓度。
答案
0.400 mol·L-1
CaO+2HCl====CaCl2+H2O
Zn+2HCl====ZnCl2+H2↑
由于Zn跟HCl反应放出H2,知CaO与盐酸反应中盐酸过量,CaO全部与HCl反应生成CaCl2,即所得溶液是CaCl2和HCl的混合液。
法一:守恒法
Ag++Cl-====AgCl↓
Cl-全部来自于盐酸中
c(HCl)=n(Cl-)=n(AgCl)×2=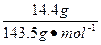 ×2≈0.200 mol
×2≈0.200 mol
c(HCl)= ="0.400" mol·L-1。
="0.400" mol·L-1。
法二:关系式(量)法
跟CaO反应的盐酸
n1(HCl)=2n(CaO)=2×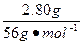 ="0.100" mol
="0.100" mol
跟Zn反应的盐酸
n2(HCl)=2×2n(H2)=2×2×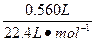 ="0.100" mol
="0.100" mol
总盐酸量n(HCl)="0.200" mol
c(HCl)= ="0.400" mol·L-1。
="0.400" mol·L-1。
