问题
问答题
现有氧化铜和铜的混合物,对其成分进行分析.取20g样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量分数及剩余固体的质量记录于下表:
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入稀硫酸的质量/g | 40 | 40 | 40 | 40 | 40 |
| 充分反应后剩余固体质量/g | 16 | 12 | 8 | 6 | m |
(1)上述表格中m的值为______.
(2)计算第三次加稀硫酸后所得溶液中溶质的质量分数.
答案
(1)根据实验数据分析可知,每40克稀硫酸与4克氧化铜恰好完全反应,第四次加入40克稀硫酸后只反应了2克氧化铜,说明氧化铜已反应完,第五次再加入稀硫酸,剩余固体的质量也不会减少.所以m的值为6.则混合物中铜的质量是6g;
(2)设第三次加稀硫酸反应后所得溶液中溶质的质量为y
CuO+H2SO4═CuSO4+H2O
80 160
12g y
=80 12g 160 y
y=24g
第三次加稀硫酸反应后所得溶液中溶质质量分数=
×100%=18.2%24g 120g+12g
故答案为:(1)6;(2)第三次加稀硫酸反应后所得溶液中溶质质量分数为18.2%.

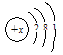 ,则x的值为 。根据元素原子结构示意图,不能直接获得的信息是 (填编号)。
,则x的值为 。根据元素原子结构示意图,不能直接获得的信息是 (填编号)。