漂白粉在生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。2003年抗“非典”期间,各商场漂白粉及其他漂白产品曾一度脱销。
(1)1998年,我国长江流域和松花江流域都发生了百年不遇的特大洪水。灾区人们的饮用水,必须用漂白粉等药品消毒后才能饮用,以防传染病发生,但瓶装漂白粉久置空气中会失效。试用化学方程式表示漂白粉在空气中易失效的原因:① ;② 。
(2)已知浓盐酸和次氯酸钙能发生如下反应:
Ca(ClO)2+4HCl(浓)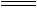 CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O
用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是()
①CO2 ②HCl ③H2O ④O2
A.①②③ B.②③④ C.②③ D.①④
(3)用Cl2和石灰乳制作漂白粉的目的是()
A.转变为较HClO稳定且易储运的物质
B.转变为更易溶于水的物质
C.提高氯气的利用率
D.增强漂白能力
(1)①Ca(ClO)2+CO2+H2O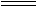 CaCO3↓+2HClO ②2HClO
CaCO3↓+2HClO ②2HClO 2HCl+O2↑
2HCl+O2↑
(2)A (3)AB
(1)漂白粉的成分是Ca(ClO)2和CaCl2,而能起漂白作用的是Ca(ClO)2,所以漂白粉的有效成分是Ca(ClO)2,它在空气中失效的化学方程式为:
①Ca(ClO)2+CO2+H2O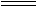 CaCO3↓+2HClO
CaCO3↓+2HClO
②2HClO 2HCl+O2↑
2HCl+O2↑
所以,漂白粉应密闭保存,避免与空气接触。
(2)漂白粉久置后可能会失去漂白作用,因为发生以下反应:
Ca(ClO)2+CO2+H2O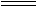 CaCO3↓+2HClO;2HClO
CaCO3↓+2HClO;2HClO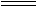 2HCl+O2↑
2HCl+O2↑
因此当贮存很久的漂白粉与浓盐酸反应时会有CO2气体产生,而反应过程中产生的水及浓盐酸中氯化氢的外逸,也是不可避免的。因此本题选A。
(3)HClO容易分解,Ca(ClO)2等盐较稳定且为固体,便于储运;Ca(ClO)2溶解度要比Cl2大得多。所以选A、B。
