如图中,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.
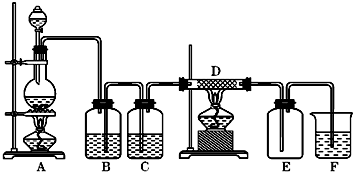
(1)上述装置中有一处错误,请指出是______处(用字母表示).
(2)通过B是为了除去______,在B中应加入______;通过C是为了除去______.
(3)写出D、F中发生反应的化学方程式______、______.
(4)如果A中产生氯气3.36L(标准状况),请计算:
①写出A中方程式,并用双线桥法分析A中的电子转移情况______.
②消耗MnO2的物质的量______.
③被氧化的HCl的物质的量______.
(1)B装置是除去氯气中含杂质气体氯化氢,装置中导管短进长出,洗气装置除杂质要遵循长进短出,所以B装置错误;故答案为:B;
(2)浓盐酸有挥发性,所以氯气中含有氯化氢气体,氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和食盐水除去氯气中混有的氯化氢气体;水蒸气和铁在高温的条件下反应干扰实验,利用浓硫酸的吸水性,且不和氯气反应,用浓硫酸干燥氯气,
故答案为:HCl;饱和食盐水;水蒸气;
(3)氯气有强氧化性,能把变价金属氧化成最高价态,所以氯气和铁反应的生成物是氯化铁;氯气有毒,污染环境,所以不能排空,氯气能和氢氧化钠反应生成氯化钠、次氯酸钠、水,所以可用氢氧化钠吸收多余的氯气,
故答案为:2Fe+3Cl2
2FeCl3 ;Cl2+2NaOH=NaCl+NaClO+H2O; 点燃 .
(4)①氧化还原反应根据氧化剂和还原剂可以分为:完全氧化还原反应和部分氧化还原反应,这是一个部分氧化还原反应,化合价降低元素是Mn元素,二氧化锰为氧化剂,化合价升高元素是Cl元素,HCl是还原剂,但氯化氢部分(50%)被氧化,故答案为:

;
②由反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O系数比得:n(MnO2)=n(Cl2)= △ .
=0.15mol,3.36L 22.4L/mol
故答案为:0.15mol;
③由反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O系数比得:被氧化的HCl的物质的量n(HCl)=2n(Cl2)=2×0.15mol=0.3mol, △ .
故答案为:0.3mol.
