问题
计算题
(10分)电闪雷鸣是自然界中司空见惯的现象,地球上每年平均发生31万余次闪电。
(1)当电闪雷鸣之时,空气中会发生很多化学反应,试写出与氮元素有关的化学方程式。
(2)设某次雷电中放出的能量为1.5×107kJ,空气中的氮气和氧气直接化合,已知1 mol O2和1 mol N2化合时要吸收180.74 kJ的能量,闪电时有1/1 000的能量用于这一反应,那么:①此次闪电所产生的NO的物质的量有多少?②此次雷雨闪电的生成物相当于给土地施了多少尿素〔CO(NH2)2〕化肥?
答案
(1)N2+O2 2NO
2NO
2NO+O2====2NO2 3NO2+H2O====2HNO3+NO
(2)①165.98 mol
②此次雷雨闪电的生成物相当于给土地施了4 979.4 g的尿素化肥。
(1)N2+O2 2NO
2NO
2NO+O2====2NO2 3NO2+H2O====2HNO3+NO
(2)①由(1)化学方程式可知,1 mol O2和1 mol N2化合生成2 mol NO,所以此次闪电所产生的NO的物质的量为
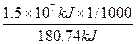 ×2 mol="165.98" mol
×2 mol="165.98" mol
②设此次雷雨闪电的生成物相当于给土地施了x g尿素化肥,可列方程式:
165.98 mol×30 g·mol-1×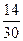 ="x" g×
="x" g×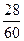
解得,x="4" 979.4
所以此次雷雨闪电的生成物相当于给土地施了4 979.4 g的尿素化肥。
