问题
填空题
已知实验室制氯气的化学方程式为:MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O,其中:
(1)MnO2中Mn元素被______.
(2)HCl中氯原子______(填“得到”或“失去”)电子.
(3)反应中还原剂与氧化剂的物质的量之比为______.
(4)若参加反应的HCl是146g,则被氧化的HCl是______mol.
(5)用单线桥法表示此反应中电子转移情况.MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O.
答案
(1)因反应中二氧化锰中的Mn元素的得电子化合价降低而被还原,故答案为:还原;
(2)反应中氯元素的化合价升高,则氯元素失去电子,故答案为:失去;
(3)由MnO2+4HCl=MnCl2+2H2O+Cl2↑可知,1molMnO2反应时氧化剂为1mol,但参加反应的4molHCl中只有
2molHCl作还原剂,即还原剂与氧化剂的物质的量之比为2:1,故答案为:2:1;
(4)参加氧化还原反应的氯化氢是参加反应的氯化氢的一半,所以被氧化的氯化氢的质量是73g,其物质的量=
=2mol,故答案为:2; 73g 36.5g/mol
(5)该反应中Cl元素失去电子,Mn元素得到电子,转移的电子总数为2e-,则电子转移的方向和数目
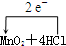
(浓)═MnCl2+Cl2↑+2H2O,故答案为:
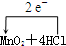
(浓)═MnCl2+Cl2↑+2H2O.

