小林和小明在实验室用右图装置做CaCO3受热分解的实验.加热一段时间后,两人对试管内剩余固体的成分进行探究.请你参与探究.
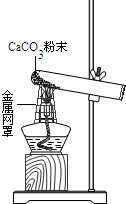
【提出问题】加热CaCO3后残留的固体成分是什么?
【作出猜想】
猜想1:CaCO3完全分解,固体成分为______;
猜想2:CaCO3未完全分解,固体成分为CaO、CaCO3;
猜想3:CaCO3未分解,固体成分为CaCO3.
【实验与事实】
(1)小林取少量残留固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液,溶液变红.
(2)小明取少量残留固体于试管中,先加适量水振荡后静置,再滴几滴无色酚酞试液,溶液变红.接着加过量稀盐酸,有气泡生成,该反应的化学方程式是______.
反应过程中固体逐渐消失,你认为还应该看到的现象是______.
【结论与交流】小林认为猜想1成立,他的结论是______(填“合理”或“不合理”)的.你认为猜想______成立.
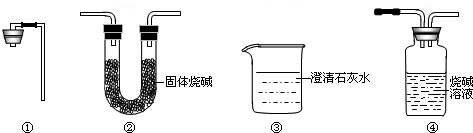
【拓展与迁移】若给上图实验装置增加下列仪器中的______(填序号),就可以直接根据实验判断CaCO3是否分解.
(1)根据反应前后元素的种类不变以及猜想2、3,可推测可能为:CaO;故答案为:CaO;
(2)氧化钙可与水反应生成氢氧化钙,溶液显碱性,可使酚酞变红,碳酸钙可与稀盐酸反应生成二氧化碳,根据题意,可知固体中有氧化钙、碳酸钙,所以猜想1不成立,猜想2成立,因为加入盐酸过量,所以反应后溶液为酸性,酸性溶液使酚酞不变色,要检验碳酸钙分解,可检验是否有二氧化碳生成,用澄清的石灰水.
故答案为:
CaCO3+2HCl=CaCl2+CO2↑+H2O;溶液由红色变无色;不合理;2;①③.
