我们在实验室做完“二氧化碳的制取”实验后,将废液倒入桶中收集了大量的混合溶液(考虑固体杂质).为避免污染环境,化学兴趣小组做了如下实验:
取废液桶上层清液共59.4kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如图所示:
| 小资料: 氯化钙溶液的PH为7, NaCO3+CaCl2=2NaCl+CaCO3↓ |
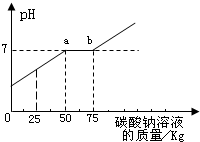
(1)通过图分析,桶中的废液里含有的溶质是______.
(2)通过图可知,当碳酸钠溶液质量加到______kg时,废液恰好处理完.
(3)图中标示a点的含义______.
(4)最终所得溶液中氯化钠的质量为______.
(1)由图象可看出,反应后的废液中pH小于7,故盐酸有剩余,因此桶中废液的溶质为HCl和生成的CaCl2,
(2)在废液中加入碳酸钠,先与盐酸反应生成氯化钠、水和二氧化碳,然后碳酸钠与氯化钙反应生成碳酸钙沉淀,因为既使先与氯化钙反应生成碳酸钙,接着碳酸钙就被盐酸溶解了;随着碳酸钠的不断滴加,PH不断升高,当盐酸恰好完全反应完时pH等于7,之后碳酸钠与氯化钙反应,pH不变,当氯化钙反应完,碳酸钠有剩余时pH大于7,故图象的三段分别表示碳酸钠与盐酸反应,碳酸钠与氯化钙反应,碳酸钠剩余.由图中数据可知当碳酸钠溶液质量加到75kg时,废液恰好处理完.
(3)图中标示a点的含义a点是碳酸钠与盐酸恰好完全反应,pH等于7,溶液显中性.
(4)根据题意写出化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑;Na2CO3+CaCl2=CaCO3↓+2NaCl根据反应前后元素质量不变可看出参加反应的碳酸钠中的钠元素全部生成了氯化钠,可找出碳酸钠与氯化钠的关系式,根据关系式可求出氯化钠的质量.
设氯化钠的质量为x
由化学方程式
Na2CO3+2HCl═2NaCl+H2O+CO2↑;Na2CO3+CaCl2=CaCO3↓+2NaCl.
可得关系式:Na2CO3~2NaCl
106 117
75g×21.2% x
=106 75g×21.2% 117 x
x=17.55g
故答案为:
(1)HCl和CaCl2 .
(2)75
(3)a点是碳酸钠与盐酸恰好完全反应,pH等于7,溶液显中性.
(4)11.7 kg+5.85kg=17.6 kg.
