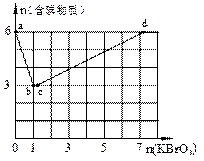
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。已知
①BrO3-+6I一+6H+=3I2+Br-+3H2O;
②2BrO3- +I2 = 2IO3- + Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由
。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值
为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 ;阴极观察到的现象是 ;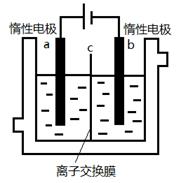
(1)1:6(2分);KBr;(2分)
(2)BrO3-+ 5Br- + 6H+ =3Br2 + 3H2O(2分);
(3)不正确(1分);该反应I2作还原剂,Br2还原产物,应得出还原性I2>Br2(合理即可,2分);
(4)7.2mol (2分)
(5)2I――2e-=I2(或 I-+6OH――6e-=IO3-+3H2O)(2分);有气泡产生
