某校化学兴趣小组为了解碳酸氢钠粉末(NaHCO3)的化学性质,进行了如图实验探究,请你一起参与他们的活动.该小组成员将少量碳酸氢钠粉末置于下图装置的试管中,充分加热至反应完全,发现试管口出现无色液体,澄清石灰水变浑浊,且试管底部有白色固体残余.根据质量守恒定律,两位同学提出以下猜想: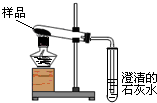
(1)提出问题:残余白色固体的成分是什么?
(2)猜想与假设:
根据化学反应前后元素种类不变,两位同学提出以下猜想:
【猜想一】甲同学:“白色固体是氢氧化钠(NaOH)”;
【猜想二】乙同学:“白色固体是碳酸钠(Na2CO3)”.
(3)实验与结论:
①澄清石灰水变浑浊的反应方程式:______;
②为了验证自己的猜想,甲同学设计了以下方案并实验验证:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量残余固体于试管中,加入适量的水使之溶解,往试管中滴加2滴无色酚酞溶液,观察现象 | 溶液变红 | 白色固体是氢氧化钠 |
③以下是乙同学设计的实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量残余固体于试管中,加入适量______,观察现象 | 试管中产生大量气泡 | ______ |
(4)讨论交流:
你还能设计不同的实验方案来验证乙同学的猜想吗?如果能你将获得激励分4分
| 实验步骤 | 实验现象 | 实验结论 |
(2)根据化学反应前后元素种类不变或化学反应前后原子种类不变或反应物NaHCO3中含有Na、H、C、O等元素,依反应前后元素种类不变,故可能生成NaOH或Na2CO3;
(3)①能使澄清石灰水变浑浊的气体应为二氧化碳,所以化学方程式为:CO2+Ca(OH)2══CaCO3↓+H2O;
②因为碳酸氢钠溶液也是呈碱性的,所以不能根据酚酞变红色来推断一定是氢氧化钠;
③碳酸钠遇酸能生成二氧化碳气体;取少量残余固体于试管中,加入适量稀盐酸,试管中产生大量气泡,说明该固体产物为碳酸钠;
④利用试管壁上的水珠判断有水生成,且生成的气体通入澄清石灰水中,石灰水中变浑浊,所以确定有二氧化碳生成,碳酸氢钠加热分解的化学方程式:2NaHCO3
Na2CO3+H2O+CO2↑;△ .
(4)根据物质的溶解性可知,鉴别碳酸盐可以用钡离子来检验,可以加入氯化钡溶液,
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量残余固体于试管中,加水充分溶解,加入足量的BaCl2溶液, | 有白色沉淀产生 | 白色固体是碳酸钠 |
(3)①CO2+Ca(OH)2══CaCO3↓+H2O;
②NaOH与Na2CO3的水溶液均显碱性,都能使无色酚酞试液变红;
③稀盐酸,白色固体是碳酸钠;
④2NaHCO3
Na2CO3+H2O+CO2↑;加热 .
(4)
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量残余固体于试管中,加水充分溶解,加入足量的BaCl2溶液, | 有白色沉淀产生 | 白色固体是碳酸钠 |
