某NaCl样品在生产过程中可能含有残余的MgCl2、CaCl2和Na2SO4三种物质中的一种或几种,现按如图所示进行检验,出现的现象如图中所述.(设过程中所有发生的反应都恰好完全进行,微溶性物质视为完全溶解.)
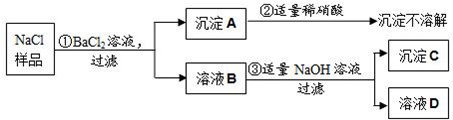
试根据实验过程和发生的现象,回答下列问题:
(1)沉淀A是(写化学式)______.
(2)实验步骤①的现象可以说明混进的物质有(写化学式)______.
(3)实验证明,溶液B中一定存在的溶质是(写化学式)______.
(4)实验过程③中发生反应的化学方程式为______.
(5)上述实验现象还不能确认CaCl2是否残留在了NaCl样品中,请你利用溶液D进行实验确认判断:(说明选用试剂、现象和结论)______.
向溶液中加入氯化钡溶液产生不溶于硝酸的沉淀,因此A是硫酸钡沉淀,则说明含有硫酸钠;向溶液B中滴加氢氧化钠溶液产生沉淀,因此说明含有氯化镁,产生的沉淀是氢氧化镁沉淀;证明氯化钙可以利用碳酸钠,看是否产生沉淀,因此:
(1)沉淀A是硫酸钠和氯化钡产生的硫酸钡沉淀,化学式为:BaSO4;
(2)实验步骤①的现象可以说明混进的物质有硫酸钠,与氯化钡反应产生沉淀;
(3)实验证明,溶液B中一定存在的溶质是氯化钡和硫酸钠反应产生的氯化钠,及与氢氧化镁反应产生沉淀的氯化镁;
(4)实验过程③是氯化镁和氢氧化钠反应产生氢氧化镁沉淀和氯化钠,发生反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
(5)根据现象无法确定氯化钙的存在,可以加入碳酸钠溶液,若产生沉淀则含有氯化钙,否则不含有;
故答案为:(1)BaSO4;(2)Na2SO4;(3)NaClMgCl2
(4)MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(5)用试管取少量溶液D,向其中滴入适量Na2CO3溶液,若出现白色沉淀,则说明原样品中含有CaCl2;若无明显现象,则说明原样品中没有CaCl2.
