同学们对实验“煅烧石灰石”展开深入探究.
①煅烧石灰石.可观察到石灰石的表面______.
②为证明石灰石已分解,三位同学从其他角度设计方案如下:
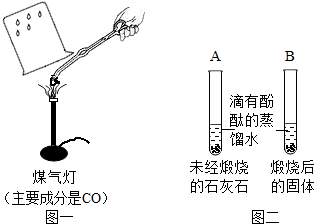
Ⅰ.甲同学按图一所示进行实验(煤气灯亦能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式______.
Ⅱ.乙同学按图二所示进行试验,观察到B中液体变______色,A中实验的作用______.
Ⅲ.丙同学取一块石灰石进行煅烧,一段时间后发现固体质量减轻mg(即CO2的质量),证明石灰石已分解.
IV.大家认为甲同学的方案不合理,请分析原因______.
③为测定石灰石的纯度,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生mg气体,结合上述数据计算可知,丙所取的这块石灰石中含碳酸钙______mol(用m表示).
①石灰石分解会产生二氧化碳,所以可以看到石灰石的表面会产生气泡;
②Ⅰ、石灰水变浑浊是由于二氧化碳和澄清石灰水发生了反应,该反应生成了难溶于水的碳酸钙,其化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
Ⅱ、氧化钙可以和水反应生成氢氧化钙,而氢氧化钙溶液呈碱性,可以使酚酞试液变红,所以可以观察到试管B中液体变红,试管A起到了对照作用;
Ⅳ、煤气灯的主要成分为一氧化碳,而一氧化碳燃烧生成了二氧化碳,所以澄清石灰水变浑浊不一定是来源于碳酸钙的分解;
③根据题中信息可以知道生成二氧化碳的气体的质量为2m克,碳酸钙的化学式可以分拆为:CaO•CO2,所以碳酸钙的物质的量为:2mg÷(
×100%)÷100g/mol=44 100
molm 22
故答案为:①有气泡产生;
②Ⅰ、Ca(OH)2+CO2═CaCO3↓+H2O;
Ⅱ、红;对照;
Ⅳ、煤气灯的主要成分为一氧化碳,而一氧化碳燃烧生成了二氧化碳,所以澄清石灰水变浑浊不一定是来源于碳酸钙的分解;
③
.m 22