已知:①高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH = a kJ/mol
2Fe(s)+3CO2(g) ΔH = a kJ/mol
(1)已知:
①Fe2O3(s)+ 3C(石墨) = 2Fe(s)+3CO(g) ΔH1= + 489.0 kJ/mol
②C(石墨)+CO2(g) = 2CO(g) ΔH2= + 172.5 kJ/mol
则a =_______kJ/mol。
(2)冶炼铁反应的平衡常数表达式K =________ ,温度升高后,K值_________(填“增大”、 “不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
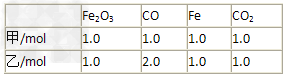
①甲容器中CO的平衡转化率为____________。
②下列说法正确的是___________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的
d.甲、乙容器中,CO的平衡浓度之比为2∶3
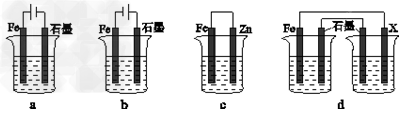
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是________(填字母),若用d装置保护铁,X极的电极材料应是_______(填名称)。
②写出b装置中Fe电极的电极反应式 _______________ 。
(1)-28.5
(2)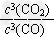 ;减小
;减小
(3)①60 % ;②ad
(4)①bc;锌;②2H++2e-=H2↑