小丽同学在某化工厂参加社会实践,与技术员一起分析由Na2CO3和NaCl组成的样品中NaCl的质量分数。现取15g该固体样品,全部溶于200mL水中,向所得到的混合溶液中逐滴滴入溶质质量分数为7.3%的稀盐酸,记录了如下图所示的曲线关系。(水的密度为1g/mL,计算结果精确到0.1%)
(1)当Na2CO3与稀盐酸恰好完全反应时,消耗7.3%的稀盐酸的质量是 g;
(2)样品中NaCl的质量分数是多少?
(3)计算Na2CO3与稀盐酸恰好完全反应时,所得溶液的溶质质量分数。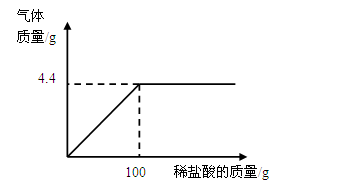
(1) 100 ;
(2)Na2CO3 + 2HCl ="=" 2NaCl + CO2↑ + H2O
106 117 44
X Y 4.4g
X =" 10.6" g 样品中NaCl% =" (15g" – 10.6g)/15g =29.3%
(3) Y = 11.7g
溶液中NaCl% =(11.7g+15g–10.6g)/(15g+200g+100g-4.4g)=5.2%
(1)由图示可知,加入盐酸到100g时,气体不再生成,说明反应已完全;
故答案为:100g;
(2)设样品中碳酸钠的质量为x,生成氯化钠的质量为y,
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
x y 4.4g
106: x ="117:" y ="44:" 4.4g
x="10.6" g y=11.7g
样品中NaCl的质量分数=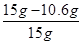 =29.3%
=29.3%
(3)Na2CO3与稀盐酸恰好完全反应时,所得溶液为氯化钠溶液,溶质质量为11.7g+15g-10.6g=16.1g,溶液的质量=15g+200g+100g-4.4g=310.6g
溶液中NaCl%=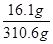 ×100%=5.2%.
×100%=5.2%.
点评:本题主要考查学生对完全反应的认识,以及运用化学方程式和溶质质量分数公式进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
