实验室制取Cl2的化学方程式为MnO2 + 4HCl 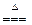 MnCl2 + Cl2↑+ 2H2O,当有146.0克HCl完全参加反时,有多少摩氧化剂被还原?有多少摩还原剂被氧化?还原产物为多少克?生成的氧化产物在标准状况下的体积是多少升?(每问3 分)
MnCl2 + Cl2↑+ 2H2O,当有146.0克HCl完全参加反时,有多少摩氧化剂被还原?有多少摩还原剂被氧化?还原产物为多少克?生成的氧化产物在标准状况下的体积是多少升?(每问3 分)
解:设质量为X的氧化剂被还原,生成质量为Y的还原产物,生成质量为Z 的氧化产物。
MnO2 + 4HCl 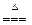 MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
87 146 126 71
X 146g Y Z
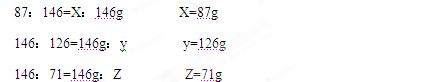
(1)87g÷87g/mol="1mol "
(2)146g÷36.5 g/mol÷2=2mol
(3)还原产物126g
(4)71g÷71g/mol×22.4L/mol=22.4L

