(2011年广东,21题)下表是NaOH和Ca(OH)2的溶解度数据,请回答下列问题。
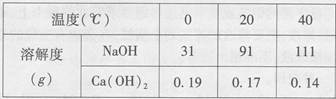
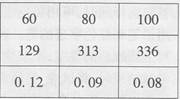
(1)从表中数据可以获得的信息是___________(写一条)。
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是_______;现有20℃是Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液的溶质质量分数乙______甲(填>、<、=)。
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答:
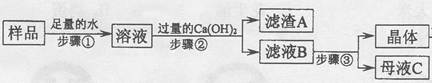
(Ⅰ)步骤①反应的化学方程式为________;加入过量Ca(OH)2的目的是______________。
(Ⅱ)滤液B中的溶质是__________、_________(写化学式);步骤③所包含的具体操作是加热浓缩、_______、过滤。
(1)氢氧化钠的溶解度随温度的升高而增大(2)溶液中有晶体析出;<(3)Na2CO3+10H2O==Na2CO3·10H2O;将碳酸钠除去;NaOH;Ca(OH)2;降温
分析:(1)利用表中氢氧化钠与氢氧化钙的溶解度数值可找到相关的信息.
(2)利用氢氧化钠的溶解度随温度降低而减小的知识以及氢氧化钙溶解度随温度升高而减小,同时结合生石灰溶于水放热的知识解决此题.
(3)I、变质的氢氧化钠常会含有碳酸钠,碳酸钠与氢氧化钙反应会生成碳酸钙与氢氧化钠,过量的氢氧化钙会把碳酸钠清除的更干净一些.
II、滤液B中会含有剩余的氢氧化钙及氢氧化钠两种溶质,由氢氧化钠和氢氧化钙的溶解度与温度的关系可确定分离它们的方式.
解答:解:(1)相同温度下氢氧化钠与氢氧化钙的溶解度大小区别很大.
故答案为:氢氧化钠的溶解度远远大于氢氧化钙的溶解度.
(2)由于氢氧化钠的溶解度随温度降低而减小,故降温会使溶液析出溶质,氧化钙溶液水后放热溶液温度升高,氢氧化钙溶解度随温度升高而减小,故可形成高温时的饱和溶液,此溶液要比低温时溶质质量分数小.
故答案为:溶液会变浑浊;<
(3)I、变质的氢氧化钠常会因氢氧化钠与二氧化碳反应含有碳酸钠,碳酸钠与氢氧化钙反应会生成碳酸钙与氢氧化钠,为把碳酸钠清除的更干净一些常会加入过量的氢氧化钙.
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;将溶液中的碳酸钠完全转化为氢氧化钠.
II、由于溶液中加入了过量的氢氧化钙,所以滤液中会含有氢氧化钠与氢氧化钙,因为这两种物质的溶解度随温度的变化差异很大,故可采用降温结晶的方式进行分离.
故答案为:Ca(OH)2;NaOH;降温结晶
