问题
问答题
将铜、锌两种金属的混合物20g,放入100g稀硫酸中恰好完全反应,共放出0.2g氢气.
求:(1)原混合物中锌的质量百分含量.
(2)反应后所得溶液的质量百分比浓度.
答案
设混合物中含锌的质量为x,生成硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
═65 x
═161 y 2 0.2g
解得x=6.5g,y=16.1g
混合物中锌的质量百分含量=
×100%=32.5% 6.5 20
反应后硫酸锌溶液的质量=6.5g+100g-0.2g=106.3g
反应后硫酸锌溶液的质量百分比浓度=
×100%=15.1% 16.1 106.3
答:(1)原混合物中锌的质量百分含量为32.5%;(2)反应后所得溶液的质量百分比浓度为15.1%.

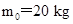 、长为L=5 m的木板放在水平面上,木板与水平面的动摩擦因数为
、长为L=5 m的木板放在水平面上,木板与水平面的动摩擦因数为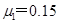 .将质量m=10 kg的小木块(可视为质点),以
.将质量m=10 kg的小木块(可视为质点),以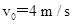 的速度从木板的左端水平抛射到木板上(如图所示),小木块与木板面的动摩擦因数为
的速度从木板的左端水平抛射到木板上(如图所示),小木块与木板面的动摩擦因数为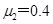 (最大静摩擦力等于滑动摩擦力,
(最大静摩擦力等于滑动摩擦力,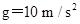 ).则以下判断中正确的是( )
).则以下判断中正确的是( )