(14分)某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。请回答下列问题:
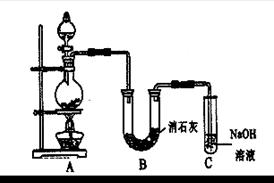
(1)A为实验室制氯气的发生装置,反应方程式为 。
某学生用12mo1·L-1的浓盐酸100mL和足量的MnO2反应制Cl2,实际得到的
Cl2 6.72L(填“<”或“>”或“=”)。
(2)漂白粉将在U形管中产生,其化学方程式是 。
(3)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 。
②试判断另一个副反应是 (写化学方程式),为避免此副反应的发生,可将装置作何改进? 。
(4)C装置的作用是 。
1)MnO2+4HCl(浓)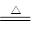 MnCl2+Cl2↑+2H2O ; <
MnCl2+Cl2↑+2H2O ; <
(2) 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(3) ①冷却B装置(或将B装置置于冷水浴中)
② 2HCl+Ca(OH)2=CaCl2+2H2O ; 在A、B间连接一个装有饱和食盐水的洗气瓶
(4)吸收未反应的氯气,防止污染空气
(1)实验室正确氯气利用的是浓盐酸和二氧化锰发生氧化还原反应得到氯气,方程式为MnO2+4HCl(浓)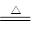 MnCl2+Cl2↑+2H2O。由于在反应过程中,浓盐酸的浓度逐渐降低,而稀盐酸是不能被二氧化锰氧化生成氯气的,所以实际生成的氯气要小于理论值。
MnCl2+Cl2↑+2H2O。由于在反应过程中,浓盐酸的浓度逐渐降低,而稀盐酸是不能被二氧化锰氧化生成氯气的,所以实际生成的氯气要小于理论值。
(2)氯气和消石灰反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(3)温度会发生副反应,所以可通过降低反应的温度来实现,即可以把B装置置于冷水浴中;由于制取的氯气中会混有氯化氢气体,而氯化氢和消石灰反应生成氯化钙,方程式为
2HCl+Ca(OH)2=CaCl2+2H2O。因此要避免该反应的发生,就需要除去氯气中的氯化氢气体,即可以在A、B间连接一个装有饱和食盐水的洗气瓶。
(4)氯气有毒,需要进行尾气除了,以防止污染空气。
