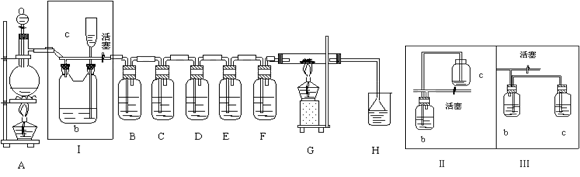
(14分) 如图所示是一个制取Cl2并以Cl2为原料进行特定反应的装置,其中各试剂瓶所装试剂为:B(Na2S)、C(FeBr2)、D(淀粉-KI)、E(SO2和BaCl2)、F(水)、H(紫色石蕊)
(1)写出实验室制取Cl2的化学方程式___________________________________________________________
(2)Ⅰ中b瓶内加入的液体是 。装置Ⅰ还可用右图中的装置_______(Ⅱ或Ⅲ)代替
(3)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让Cl2充满整个装置,再点燃G处酒精灯,回答下列问题:
①下列装置中的现象是B _________________;D _______________________ __
②写出E中反应的离子方程式:
_____________________________________;________________________________________
(4)G中硬质玻璃管内盛有碳粉,反应后的产物为CO2和HCl,写出G中的反应的化学方程式__________
(5)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__________________________
(14分) (1)MnO2+4HCl(浓) MnCl2+H2O+Cl2↑ (2)饱和食盐水 Ⅱ
MnCl2+H2O+Cl2↑ (2)饱和食盐水 Ⅱ
(3)①有浅黄色沉淀生成;溶液变蓝
②Cl2+SO2+2H2O=4H++SO42-+2Cl- Ba2++SO42-=BaSO4↓
(4) C+2H2O+2Cl2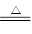 CO2↑+4HCl↑
CO2↑+4HCl↑
(5)Cl2与H2O反应生成的HCl使紫色石蕊试液变红色,剩余的Cl2又与水作用生成HClO,又起漂白作用,使红色褪去
题目分析:(1)实验室制取氯气的方程式是MnO2+4HCl(浓) MnCl2+H2O+Cl2↑。
MnCl2+H2O+Cl2↑。
(2)由于浓盐酸具有挥发性,所以生成的氯气中含有氯化氢气体,所以b瓶内加入的液体是饱和食盐水,目的是除去氯气中的氯化氢气体。装置Ⅰ的作用是起安全瓶的作用,所以还可用右图中的装置应该是Ⅱ。
(3)①氯气具有强氧化性,能氧化硫化钠生成单质S,所以B中有浅黄色沉淀生成;氯气能把碘化钾氧化生成单质碘,而碘遇淀粉显蓝色。
②由于氯气能把SO2氧化生成硫酸,进而生成硫酸钡白色沉淀,所以E中反应的离子方程式是Cl2+SO2+2H2O=4H++SO42-+2Cl-、Ba2++SO42-=BaSO4↓。
(4)根据生成物可知,有水参加,所以反应的方程式是C+2H2O+2Cl2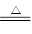 CO2↑+4HCl↑。
CO2↑+4HCl↑。
(5)由于Cl2与H2O反应生成的HCl使紫色石蕊试液变红色,剩余的Cl2又与水作用生成HClO,又起漂白作用,所以使红色褪去。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。纵观近几年高考,主要以考察探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,要求考生必须冷静的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能正确作答。
