(16分)某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。
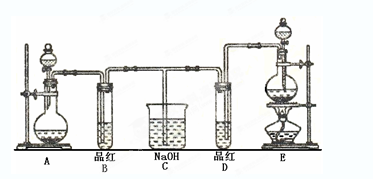
(1) 实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中 装置(填装置序号)制Cl2。
(2) 反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B: ,D: 。
(3) 装置C的作用是 。
(4) 甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:
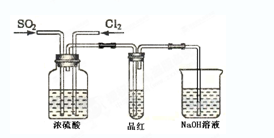
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:
。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: ,并写出其相应的离子方程式: 。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是: 。
(1) E (2) B:溶液由无色变成红色 D:溶液没有明显的变化
(3) 保证安全,吸收多余的氯气和二氧化硫
(4)①使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比列混合。
②SO2和Cl2按1:1进气,二者恰好完全反应,生成无漂白性的H2SO4和HCl
SO2 +Cl2 +2H2O===4H+ +SO42- +2Cl-
③SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性。
(1)实验室制取氯气需要加热,所以选择E装置。
(2)由于SO2的漂白是不稳定的,而次氯酸的漂白是氧化,是不能恢复原来颜色的,所以现象是B:溶液由无色变成红色;D:溶液没有明显的变化。
(3)氯气和SO2都是大气污染物,需要尾气处理。
(4)①在溶液中气体容易混合均一,且通过观察气泡的速度控制气体流量,使二者按一定比列混合。
②由于氯气均一氧化性,能把SO2氧化生成硫酸和盐酸,从而失去漂白性,方程式为SO2 +Cl2 +2H2O===4H+ +SO42- +2Cl-。
③溶液褪色,说明有气体剩余,这说明在反应中SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性。
