构建知识网络是学习的一种重要方式。甲同学用“五指法”,归纳出酸溶液的五点化学性质,如图。
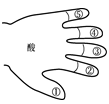
①酸使酸碱指示剂变色。
②酸与活泼金属反应,生成盐和氢气。
③酸与金属氧化物反应,生成盐和水。
④酸与碱发生中和反应,生成盐和水。
⑤酸与某些盐反应,生成新酸和新盐。
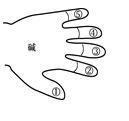
乙同学也用类似的方法,归纳碱溶液的化学性质。请你帮他完成,并写出相应的化学方程式。
①碱溶液使酸碱指示剂变色。
无色酚酞试液遇酸不变色,遇碱溶液变红色。
紫色石蕊试液遇酸变 色,遇碱溶液变 色。
②碱溶液一般不与金属反应。
③碱溶液能与某些非金属氧化物(除CO、NO外)反应,
生成盐和水,如:NaOH + CO2 —
④碱与酸发生中和反应,生成盐和水,如:
NaOH + H2SO4—
⑤碱溶液与 ,如:
2NaOH + CuSO4 ="==" Cu (OH)2↓ +Na2SO4
① 红 蓝
③2NaOH+ CO2 =Na2CO3 +H2O
④2NaOH + H2SO4= Na2SO4 + 2H2O
⑤某些盐反应,生成新碱和新盐
根据已有的知识进行分析,石蕊试液遇酸性溶液变红,遇碱性溶液变蓝,碱能与非金属氧化物反应生成盐和水,酸和碱能发生中和反应生成盐和水,碱溶液能与某些盐反应生成新盐和新碱.
解:①石蕊试液遇酸性溶液变红,遇碱性溶液变蓝,故填:红,蓝;
③氢氧化钠能与二氧化碳反应生成碳酸钠和水,故填:2NaOH+CO2=Na2CO3+H2O;
④氢氧化钠能和硫酸反应生成硫酸钠和水,故填:2NaOH+H2SO4=Na2SO4+2H2O;
⑤碱溶液能与某些盐反应,生成新碱和新盐,故填:某些盐反应,生成新碱和新盐.
本题考查了碱的性质,完成此题,可以依据已有的知识进行.
