问题
填空题
在反应中:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
(1)______元素被还原;______是氧化剂(填元素符号或化学式)
(2)Cu发生了______反应;若某元素的化合价升高了,则该元素所在的生成物称为氧化产物,该反应的还原产物是______.(填元素符号或化学式)
(3)用双线桥标出反应的电子转移方向和数目:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,若有1.5molCu发生了反应,则转移的电子的个数是______.
答案
(1)Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,反应中硫元素化合价从+6价变化为+4价,化合价降低做氧化剂,硫元素被还原,
故答案为:S;H2SO4;
(2)氧化还原反应中铜元素化合价升高,失去电子做还原剂,被氧化为氧化产物;硫元素化合价降低,硫酸得到电子做氧化剂,被还原得到还原产物SO2,
故答案为:氧化;SO2;
(3)氧化还原反应中,得电子的元素是硫,化合价降低2价,失电子的元素是铜,化合价升高2价,所以转移电子2mol;表示方法为:
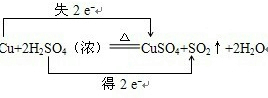
;
若有1.5molCu发生了反应,依据电子转移故选计算:Cu~Cu2+~2e-;则转移的电子的个数是3NA;
故答案为:

;3NA.
