(16分)某实验小组用浓盐酸和MnO2制取并探究Cl2化学性质,设计装置图如下图所示:
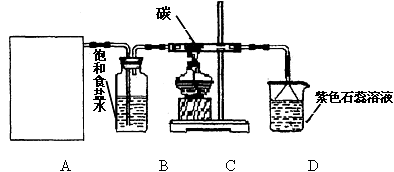
(1)A是氯气发生装置(省略未画),制备Cl2的化学反应离子方程式是 , A装置除了酒精灯、圆底烧瓶外还用到的玻璃仪器有 。
(2)从C装置出来的气体中含有CO2和HCl,则在C装置中发生的化学反应方程式为:
。
(3)同学们在实验中发现,若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成,于是开始探究该条件下不能生成氯气的原因。
①提出合理假设
假设1:H+的浓度不够大;
假设2: ;
假设3:_________________________ _ 。
②设计实验方案,进行实验。在答题卷上写出实验步骤以及预期现象和结论。
限选实验试剂:蒸馏水、浓H2SO4、NaCl固体、MnO2固体、1mol/L稀盐酸、1mol/LAgNO3溶液、淀粉-KI溶液
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量1mol/L稀盐酸于试管A中,加入少量MnO2, 。 | |
| 步骤2:取少量1mol/L稀盐酸于试管B中,加入少量MnO2, 。 |
(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2分) 分液漏斗(2分)
Mn2++Cl2↑+2H2O(2分) 分液漏斗(2分)
(2)2Cl2+2H2O+C CO2+4HCl(2分)
CO2+4HCl(2分)
(3)①假设2:Cl-的浓度不够大(1分)假设3:Cl-和H+的浓度均不够大 (1分)
②(8分)
| 实验步骤 | 预期现象与结论 |
| 滴加几滴浓硫酸,充分振荡,塞紧带导管的胶塞,导管插入淀粉-KI溶液中,加热。(2分) | ①若淀粉-KI溶液变蓝,则假设1成立; ②若淀粉-KI溶液不变蓝,则假设2或假设3成立。(2分) |
| 加入少量NaCl固体,充分振荡,塞紧带导管的胶塞,导管插入淀粉-KI溶液中,加热。(2分) | ①若淀粉-KI溶液变蓝,则假设2成立;②若淀粉-KI溶液不变蓝,结合步骤1的结论②,则假设3成立。(2分) |
本题考查了氯气的制取原理:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(1)制取氯气是固液加热的方式;一般用分液漏斗装液体,烧瓶做为反应容器。
(2)氯气在制取过程中只除去了HCl,并没有干燥,在加热条件下与C反应,产物为CO2和HCl,可知反应物为氯气、C和水
(3)探究氯气的制取原理:改变了盐酸的浓度,就可以从Cl-的浓度、H+的浓度对反应的影响进行假设、实验、验证。
