(14分)下图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹。
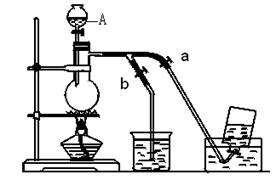
(1)仪器A的名称是 ;水槽中应盛放的是 ;烧杯中反应的化学方程式 ;
(2)在收集氯气时,应 。当氯气收集完毕时应 。(填如何控制a、b)
(3)若要制得标准状况下的Cl2 0.672L,理论上需要MnO2的物质的量是 mol。
(4)实验室也可在不加热的条件下用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
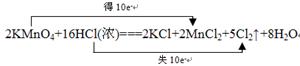
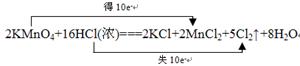
该反应中,氧化剂是 ,氧化产物是 ;当有1mol电子发生转移时,
生成氯气的体积为 (标准状况),请用双线桥表示该氧化还原反应。
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
(1)分液漏斗;饱和食盐水;Cl2+2NaOH=NaCl+NaClO+H2O。
(2)打开a, 关闭b;打开b,关闭a。 (3)0.03 mol。
(4)氧化剂是 KMnO4,氧化产物是Cl2;11.2L
题目分析:(1)仪器A的名称叫分液漏斗,为了降低氯气的溶解度,水槽应该放饱和食盐水,烧杯中应该放NaOH溶液吸收多余的氯气,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
(2)收集氯气时,应该打开a关闭b。收集完毕后应该关闭a,打开b。
(3)根据反应:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,可知制得标准状况下的Cl2 0.672,理论上需要MnO2的物质的量是0.03 mol。
MnCl2+Cl2↑+2H2O,可知制得标准状况下的Cl2 0.672,理论上需要MnO2的物质的量是0.03 mol。
(4)根据反应2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,可知氧化剂是KMnO4,氧化产物是Cl2,有1mol电子发生转移时,生成氯气的体积为11.2L。