A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):
(1)A的化学式为______,B的化学式为______,C的电子式为______.
(2)Z和W在催化剂和加热的条件下反应生成C和Y,这是一个很有意义的反应,可以消除W对环境的污染,该反应的化学方程式为______.
(3)将N溶液滴入G的溶液中会产生W,写出上述变化的离子反应方程式:______.
(4)Z与N恰好反应后产物溶解在水中,所得溶液的pH(填“大于”、“小于”或“等于”)______7,用离子反应方程式表示其原因为______.
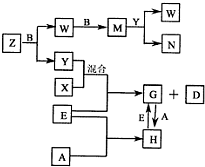
A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属,则E为铁;Y、Z与Ne的电子数相等,则Y、Z为10电子微粒,再由框图中G与H的转化可知,A是第三周期的元素,A在常温下为气体,则A为氯气,H为氯化铁,G为氯化亚铁;再由转化中X与Y混合与铁反应,则D为氢气,X为氯化氢,Y为水,即B为氧气;由Z和B→W,W和B→M,M和Y反应生成W和N,则Z为氨气,即C为氮气,W为NO,M为NO2,N为硝酸;
(1)因A为氯气,其化学式为Cl2,B为氧气,其化学式为O2,C为氮气,其电子式为
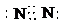
,故答案为:Cl2;O2;
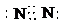
;
(2)Z和W在催化剂和加热的条件下反应生成C和Y,即氨气和NO反应生成氮气和水,其反应为6NO+4NH3
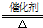
5N2+6H2O,
故答案为:6NO+4NH3
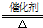
5N2+6H2O;
(3)将N溶液滴入G的溶液中会产生W,即硝酸滴到氯化亚铁溶液中发生氧化还原反应生成NO,离子反应为4H++NO3-+3Fe2+═NO↑+2H2O+3Fe3+,
故答案为:4H++NO3-+3Fe2+═NO↑+2H2O+3Fe3+;
(4)Z与N恰好反应后产物溶解在水中所得溶液为硝酸铵溶液,由铵根离子的水解反应NH4++H2O

NH3•H2O+H+可知该溶液显酸性,溶液的pH小于7,
故答案为:小于;NH4++H2O

NH3•H2O+H+.
