某校化学研究性学习小组对氯气的性质和用途进行了调查分析,了解了氯气能应用 于衣物漂白、水体的杀菌和消毒的原理。
(1) 氯气溶于水可用于漂白、消毒的原因是_______,反应的离子方程式为_______ ;
(2) 通常使用漂白液(NaClO溶液)作漂白剂而不用氯气的理由是_____(写出一项即可);
(3) 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应 (发生的反应均为放热反应)。最终生成物中含有Cl-、 ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离 子的物质的量(n)与反应时间(t)的变化曲线如下图所示。
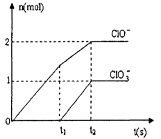
①O-t1时间内,Ca(OH)2与Cl2发生反应的化学方程式为_______;
②t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为_______
③该石灰乳中含有Ca(OH)2的质量是_______g;
(9分)
(1)氯气和水反应生成强氧化性的次氯酸(1分), Cl2+H2O=HClO+H++ClO-(1分) ;
(2)NaClO更稳定,便于储存和运输(1分);
(3)①2Ca(OH)2+2Cl2=Ca(C1O)2+CaCl2+2H2O(2分);
②10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O(2分);
③370 g (2分)
题目分析:(1)氯气和水反应生成次氯酸,次氯酸具有很强的氧化性,故氯气溶于水可用于漂白、消毒的原因是氯气和水反应生成强氧化性的次氯酸,反应的离子方程式为Cl2+H2O=HClO+H++ClO-。
(2)氯气有毒,且不容易使用,故通常使用漂白液(NaClO溶液)作漂白剂而不用氯气的理由是NaClO更稳定,便于储存和运输。
(3) ①由图像分析,t1时刻没有ClO3-离子生成,故O-t1时间内,Ca(OH)2与Cl2发生反应的化学方程式为2Ca(OH)2+2Cl2=Ca(C1O)2+CaCl2+2H2O。
②由图像分析,t2时有ClO-、ClO3-离子生成,故t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O。
③由化学方程计算得该石灰乳中含有Ca(OH)2的质量是370 g。
点评:本题考查的是氯气的性质的相关知识,题目难度中等,考查学生对基础知识的掌握程度和计算能力。
