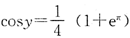2g H2和CO的混合气体与30gO2混合后,在密闭容器中完全燃烧,再冷却至室温,测知容器中混合气体的质量为23g,反应中氧气有剩余,求:
(1)原混合气体中H2的质量;
(2)反应后混合气体中各气体的质量.
(1)反应生成水的质量为:30g+2g-23g=9g,
设原混合气体中H2的质量为x,
2H2+O2
2H2O 点燃 .
4 36
x 9g
∴4:36=x:9g,
解之得;x=1g;
则用去氧气的质量为:9g-1g=8g,
(2)原混合气体中CO的质量为:2g-1g=1g,
设生成CO2的质量为y,
2CO+O2
2CO2 点燃 .
56 88
1g y
∴56:88=1g:y,
解之得:y≈1.6g,
则用去氧气的质量为:1.6g-1g=0.6g,
则剩余的氧气的质量为:30g-0.6g-8g=21.4g.
答:(1)原混合气体中H2的质量为1g;
(2)反应后混合气体中CO2的质量为1.6g,剩余的氧气的质量为21.4g.

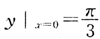 的特解是()。
的特解是()。