(4分)某校化学兴趣小组在学习完酸碱盐的化学性质后,做了以下A、B两个实验:
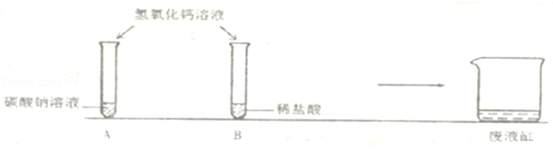
【观察与讨论】实验结束后,他们将A试管内的物质进行过滤,将滤液和B实验后的废液都倒入同一洁净的废液缸中,发现有气泡产生,最终出现白色沉淀.
他们通过分析,确定A滤液中的溶质是(些化学式) _________ ,B废液中的溶质是(写化学式) _________ .
接着,他们决定对废液缸中最终废液溶质的成分进行探究.
【提出问题】废液缸里最终的废液含有什么溶质?
【猜想与假设】小组同学进行了多种猜想:
猜想①:NaCl CaCl2 HCl
猜想②:NaCl CaCl2
猜想③:NaCl Na2CO3
…
经分析后,小组同学一致认为猜想①不成立,他们的理由是 _________ .
【活动与探究】他们为了验证自己的猜想,小华同学设计了下列实验:
| 操作步骤 | 现象 | 结论 |
| 取少量废液于试管中,向其中 滴加Na2CO3溶液 | 无明显现象 | 猜想②错误,猜想③成立 |
【观察与讨论】NaOH、Na2CO3;HCl、CaCl2.
【猜想与假设】最终能生成碳酸钙,而碳酸钙与盐酸不能共存;
【反思与评价】不正确;因为碳酸钠能与氯化钙反应生成碳酸钙的沉淀,碳酸钠不能与氯化钠反应,因此该实验时无现象只能证明溶液中不会存在氯化钙,但不能证明有无氯化钠,所以小华同学由实验现象得出的结论不正确;
【观察与讨论】在A试管中碳酸钠能与氢氧化钙反应生成氢氧化钠和碳酸钙,在B试管中盐酸与氢氧化钙反应能生成氯化钙和水,而将滤液和B实验后的废液都倒入同一洁净的废液缸中,发现有气泡产生,最终出现白色沉淀,则可知白色沉淀为碳酸钙,气泡为二氧化碳,因此溶液中存在碳酸钠和盐酸,所以可知A滤液中的溶质是NaOH、Na2CO3,B废液中的溶质是HCl、CaCl2.
【猜想与假设】因为最终生成物存在碳酸钙,而碳酸钙能与盐酸反应,所以两者不能共存,因此猜想①不成立;
【反思与评价】因为碳酸钠能与氯化钙反应生成碳酸钙的沉淀,碳酸钠不能与氯化钠反应,因此该实验时无现象只能证明溶液中不会存在氯化钙,但不能证明有无氯化钠,所以小华同学由实验现象得出的结论不正确;
