问题
问答题
某学校的研究性学习小组在实践活动中了解到,某石材厂有一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸.为了测定该石灰石的纯度,该研究性学习小组取用4g这种石灰石样品,用实验室现有稀盐酸40g分4次加入.每次充分反应后,经过滤、干燥等操作.操作后称量固体物质的质量.每次稀盐酸的用量及剩余固体的质量见下表.(假设过滤、干燥等操作过程,固体物质不受损耗)
| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入10g | 3.0g |
| 第二次加入10g | 2.0g |
| 第三次加入10g | 1.0g |
| 第四次加入10g | 0.4g |
(1)该石灰石样品的纯度是多少?
(2)第三次产生的二氧化碳的质量是多少?
答案
(1)该石灰石样品的纯度为
×100%=90%4g-0.4g 4g
(2)设第三次产生的二氧化碳的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
2g-1g x
=100 44
,x=0.44g2g-1g x
答:(1)该石灰石样品的纯度为90%.
(2)第三次产生0.44g二氧化碳.

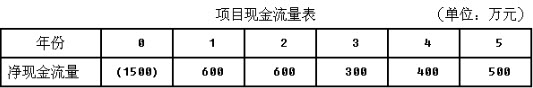
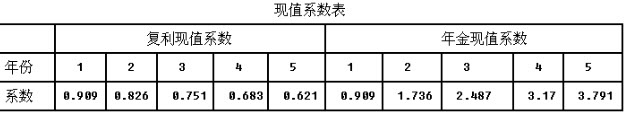 根据以上资料,回答下列问题:
根据以上资料,回答下列问题: