某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2 只发生了如下过程:H2O2→O2.
(1)该反应应选择的酸是:______(填序号).
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸.
(2)该反应中发生还原反应的过程是:______→______.
(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:______
(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为______mol.
(5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为______.
(6)H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是______.
(1)这是MnO4-酸性环境下氧化H2O2的反应,
A、盐酸也会被MnO4-氧化,故A错误;
B、浓硫酸没有必要,这里主要利用硫酸的酸性就可以了,不需要浓硫酸,浓硫酸是利用它的吸水性、强氧化性等情况才用的,故B错误;
C、稀硫酸可以提供酸性环境并且不易被高锰酸根氧化,故C正确;
D、醋酸酸性弱,还可能被MnO4-氧化,故D错误.
故选C.
(2)该反应过程中,MnO4-的Mn元素化合价降低,在反应中被还原生成Mn2+,发生还原反应,
故答案为:MnO4-;Mn2+;
(3)该反应过程中,高锰酸根的氧化性和双氧水的还原性导致二者间发生氧化还原反应,
即2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,在该反应中,化合价升高值=化合价降低值=转移电子数=10,
电子转移情况如下:
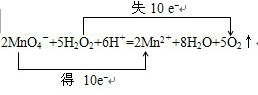
,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,

;
(4)上述反应中生成5mol氧气转移电子10mol,当反应中有6.72L(标准状况)即0.3mol氧气生成时,则转移的电子为0.6mol,故答案为:0.6;
(5)反应KCN+H2O2+H2O═A+NH3↑中,根据原子守恒可知生成物A的化学式为KHCO3,故答案为:KHCO3;
(6)H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性,所以H2O2被称为绿色氧化剂,
故答案为:H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性.
