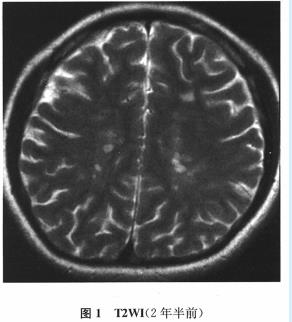
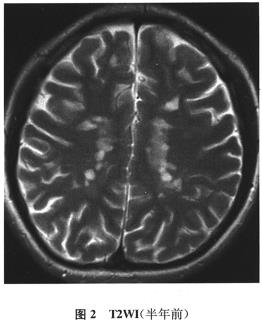
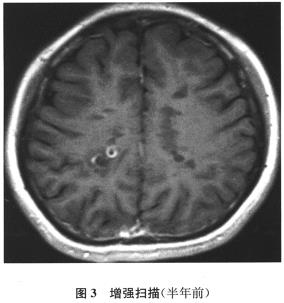
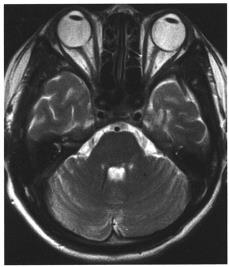
实验室可用锌与稀硫酸反应制取氢气:Zn+H2SO4═ZnSO4+H2↑.现在实验室需要氢气2.24L(标准状况下,氢气的密度为0.089g/L).
(1)求参加反应的锌的质量.
(2)某兴趣小组用的是从废旧电池中得到的含杂质10%的锌皮制取氢气.现有这种废锌皮15g,与足量的稀硫酸反应,最多得到氢气多少克?
(1)2.24 L氢气的质量为:2.24 L×0.089 g/L≈0.2 g
设参加反应的锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.2 g
=65 x 2 0.2g
x=
=6.5 g65×0.2g 2
(2)废锌皮中含锌的质量为:15 g×(1-10%)=13.5 g
设生成氢气的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 2
13.5 g y
=65 2 13.5g y
y=
≈0.42g2×13.5g 65
答:(1)参加反应的锌的质量是6.5g.(2)最多得到氢气0.42 g;