盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1) 常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性,用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性,实验室不能用浓硫酸干燥氨气,说明硫酸具有 性。
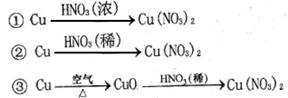
(2) 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。右图所示制备方法符合“绿色化学”思想的
是 (填序号)。
(3) ①在100ml 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
A.40.32 L
B.30.24 L
C.20.16 L
D.13.44 L②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4) 某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水,则反应的化学方程式为 。
(1)强氧化性 , 脱水性 , 酸性
(2)③
(3)① D ② 3Cu+2NO3-+8H+= 3Cu2+ +2NO+4H2O
(4)Cu+2HCl+H2O2=CuCl2+2H2O
题目分析:(2)绿色化学的理念就是没有污染或污染很少,①②均产生污染性氮氧化物气体,③中不产生。(3)与金属反应的浓硫酸一半作为氧化剂被还原为二氧化硫,但随反应进行硫酸浓度降低到一定程度会不与金属铜反应,故反应产生气体的量要小于20.16L。在加入硝酸钠,硝酸根离子在酸性条件下氧化铜,双氧水也是这个作用。

