亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯酸钠(NaClO3)等为原料制备亚氯酸钠的工艺流程如下:
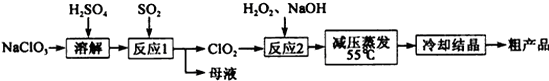
(1)提高“反应1”反应速率的措施有 。(回答一点即可)
(2)“反应1” 的离子方程式是 。
(3)“反应2”的氧化剂是 ,该反应的化学方程式为 。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是 。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL 。
(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为 。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,结果化成最简。)
(1)适当升高反应温度,增大吸收液浓度,增大SO2与吸收液的接触面积
(2)2ClO3- + SO2 =2ClO2 + SO42-
(3)ClO2 H2O2 + 2ClO2 + 2NaOH=2NaClO2 + 2H2O + O2
(4)常压蒸发温度过高,亚氯酸钠容易分解
(5)①滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色
②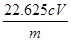 %
%
题目分析:(1)反应1是SO2气体与溶液的反应,根据反应速率增大的原理,可以是适当升高反应温度,增大吸收液浓度,增大SO2与吸收液的接触面积;气体加压会影响成本,一般不使用;反应较快不再使用催化剂。
(2)流程看出ClO3-→ClO2,Cl元素化合价降低,故氧化反应是SO2→SO42-。
(3)反应2是将ClO2→NaClO2,Cl元素化合价降低,故ClO2是氧化剂,H2O2是还原剂,其中H2O2中的-1价O变成O2。
(4)减压是为了降低物质的沸点,即降低蒸发温度,发展物质分解。
(5)①因为是用Na2S2O3标准液滴定至终点,反应是I2+2S2O32-=2I-+S4O62-,I2与指示剂淀粉产生蓝色,故终点是滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色。②由反应中的I元素守恒可知:
ClO2-~2I2~4 S2O32-,25.00mL待测溶液中n(NaClO2)=  ×cV×10-3mol,m(NaClO2)=
×cV×10-3mol,m(NaClO2)=  ×90.5cV×10-3g;样品mg配成250mL待测溶液中的NaClO2质量扩大10倍,故样品中NaClO2的质量分数为
×90.5cV×10-3g;样品mg配成250mL待测溶液中的NaClO2质量扩大10倍,故样品中NaClO2的质量分数为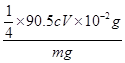 ×100%=
×100%=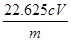 %。
%。
