氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2+H2OH++Cl-+HClO,其平衡常数表达式为K=________。
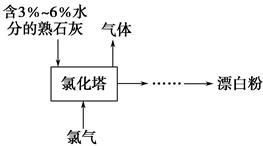
(2)工业上常用熟石灰和氯气反应制取漂白粉,反应的化学方程式是____________________________。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入,这样加料的目的是__________________________。处理从氯化塔中逸出气体的方法是________。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是____________________________________,其原因可能是__________________,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生。
(1)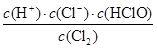
(2)2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O 充分接触(或充分吸收) 用碱液吸收(或石灰乳或碱石灰或氢氧化钠溶液等)
(3)6OH-+3Cl2=5Cl-+ClO3-+3H2O 反应放热使温度升高所致
(1)水作为溶剂(纯液体)不写入平衡常数表达式。(2)熟石灰从塔顶喷入,气体从下往上,类似于硫酸工业中SO3的吸收,这样能增大液、气的接触面积,以吸收充分。没有吸收的氯气从氯化塔中逸出,氯气的处理需要用碱性溶液吸收。(3)有KClO3生成,说明0价的氯被氧化到+5价,则一定有0价的氯化合价降低,推知为KCl,然后根据电子守恒逆向配平。一段时间后KClO3增多,则可能是KOH与氯气反应放热,使温度升高,造成了副反应增加。
