请从图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。
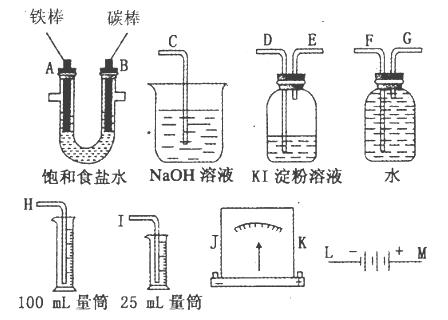
(1)A极发生的电极反应式是_____________________·B极发生的电极反应式是_______________________;电解饱和食盐水的化学方程式是______________________。
(2)电源的M端应连接的电极为____________(A或B)极。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:______________________________
__________________________________(填接口编号)。
(4)实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为________________。
(5)已知饱和食盐水50mL,某时刻测得H2体积为56mL(标准状况)。此时溶液pH约为___________________。
(1)2 H++2e-=H2↑;(2分) 2 Cl--2e-= Cl2↑(2分)
2NaCl+2H2O 2NaOH+ H2↑+ Cl2↑(2分)
2NaOH+ H2↑+ Cl2↑(2分)
(2)B(2分)
(3)H、F、G、A、B、D、E、C(2分)
(4)Cl2+2I-="2" Cl-+2I2(2分)
(5)13(2分)
题目分析:(1)A极应作阴极,H+放电,电极反应式是2 H++2e-=H2↑,B极是阳极,Cl-放电,电极反应式是2 Cl--2e-= Cl2↑电解饱和食盐水的化学方程式是2NaCl+2H2O 2NaOH+ H2↑+ Cl2↑;
2NaOH+ H2↑+ Cl2↑;
(2)M是正极应连接阳极B极,
(3)收集氢气用排水集气法,所以A→G→F→H,验证氯气的氧化性用淀粉碘化钾溶液,剩余氯气用氢氧化钠溶液吸收,所以B→D→E→C,整体连起来为H、F、G、A、B、D、E、C;
(4)在盛有KI淀粉溶液的容器中发生反应是氯气置换碘的反应,离子方程式为Cl2+2I-="2" Cl-+2I2
(5)n(H2)=0.0025mol,所以n(NaOH)=0.005mol,c(NaOH)=0.1mol/L,pH=13.
