某活动课程小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
a.取25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程式______、______.
此方案第一步的实验装置如图所示:
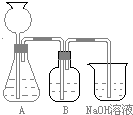
(2)加入反应物前,如何检查整个装置的气密性?______(3)装置B中盛放的试剂是______,作用是______.
(4)在实验室通常制法中,装置A还可作为下列______气体的发生装置(填序号).
①CH2═CH2 ②H2S ③CH4 ④CH≡CH ⑤H2
(5)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内.
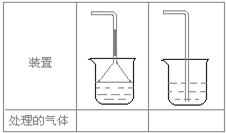
(6)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶 液密度为1.44g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为______.
(1)因过量的CO2与NaOH溶液反应生成NaHCO3,其反应为NaOH+CO2═NaHCO3,因酸式盐与碱反应生成盐和水,其反应为NaHCO3+NaOH═Na2CO3+H2O,
故答案为:NaOH+CO2═NaHCO3;NaHCO3+NaOH═Na2CO3+H2O;
(2)因装置不漏气时,通过改变气体的体积可以改变压强,故答案:用弹簧夹夹住A、B连接处,先检查A的气性:塞紧橡皮塞,从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,停止加水后,漏斗内与锥形瓶中的液面差保持不变,说明装置不漏气.然后检查B的气密性:向烧杯中注入少量水,使导管口侵入水中,双手捂住广口瓶片刻有气泡冒出,松开手后,有少量水进入导管形成水柱,说明装置不漏气(也可一次检查A、B的气密性:连接和烧杯间的乳胶管用止水夹夹住.然后从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,过一会,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气);
(3)因CO2中含有HCl,要得到纯净的CO2,必须除去HCl,同时除杂试剂不能CO2反应,所以用饱和NaHCO3溶液而不能用饱和Na2CO3溶液,故答案:饱和酸氢钠溶液;吸收HCl气体;
(4)因制备CO2、H2S、CH≡CH、H2装置的特点:固体+液体→气体,而制备CH2═CH2 装置的特点:液体+液体
气体,制备CH4装置的特点:固体+固体加热
气体,故答案:②④⑤;加热
(5)因有毒气体必须进行尾气处理,故CH4、CO2、O2不需要处理,CO虽然需要处理,但不能用液体来吸收,可用燃烧法来处理,左边的装置吸收气体要防倒吸,说明气体极易溶于水,如:NH3、HCl 右边的装置后者吸收气体没有防倒吸,说明气体不易溶于水,如:Cl2、H2S,故答案:①③;②④
(6)50mLNaOH溶液中n(NaOH)=
=0.72mol,50mL×1.44g/mL×40% 40g/mol
NaOH+CO2═NaHCO3
0.36mol 0.36mol
NaHCO3 +NaOH═Na2CO3 +H2O
0.36mol 0.36mol 0.36mol
则Na2CO3的物质的量浓度为:C=
=n v
=7.2 mol/L,0.36mol 0.05L
故答案:7.2 mol/L.
